Biologové z Kalifornské univerzity v Berkeley sekvenovali genomy 88 druhů pacifických okounů a identifikovali geny spojené s extrémně vysokou délkou života těchto zvířat. Objevené geny jsou zodpovědné za udržování struktury DNA, regulují buněčné dělení a buněčnou smrt a jsou také imunitními regulátory. Článek uveřejněný v časopise Věda.

Délka života obratlovců se velmi liší: některá zvířata žijí pouze pět týdnů (troba trpasličí), zatímco jiná žijí 400 let (žralok grónský). Jedním z nejdéle žijících zvířat je aleutský mořský okoun Sebastes aleutianus. Tato ryba pocházející z Tichého oceánu dosahuje délky jednoho metru a může se dožít více než 200 let. Jeho příbuzným je ale malý mořský okoun Sebastes viviparus žije pouze 11 let. I blízce příbuzné druhy se tedy mohou značně lišit v délce života, což naznačuje, že „tajemství dlouhověkosti“ může spočívat v jednotlivých genech.
Aby biologové z Kalifornské univerzity v Berkeley pod vedením Petera Sudmanta studovali důvody extrémně dlouhého života některých kaniců, sekvenovali genomy 88 druhů kanic žijících v Tichém oceánu. Do rodu přitom patřilo 79 druhů Sebastes, a zbývajících 9 patřilo do úzce příbuzné skupiny. Biologové stanovili stupeň vztahu mezi sekvenovanými druhy pomocí fylogenetického stromu (takové stromy odrážejí evoluční vztahy mezi nukleotidovými sekvencemi). Dlouhověké druhy byly spíše roztroušeny po celém stromě než shromážděny v jedné skupině, což naznačuje, že dlouhověkost během evoluce nastala několikrát.
Pokud gen umožňuje svému majiteli lépe se přizpůsobit podmínkám prostředí, pak je zafixován v populaci a předán dalším generacím – v tomto případě se říká, že gen podléhá pozitivní selekci. Aby biologové určili, které geny jsou zodpovědné za dlouhou životnost, vypočítali korelaci mezi geny při pozitivní selekci a délkou života. Celkem vědci objevili 91 takových genů, mnohé z nich se podílejí na buněčném růstu a dělení a také řídí apoptózu – řízenou buněčnou smrt. Kromě toho tyto geny zahrnovaly účastníky signální dráhy, která se aktivuje v reakci na přidání glukózy nebo inzulínu.
Autoři poznamenávají, že 16 z 91 genů je odpovědných za udržování struktury DNA a také za její replikaci a opravu. Některé z těchto genů byly již nalezeny u jiných dlouhověkých druhů: např. DCLRE1B, FEN1 и MCM6. Gen DCLRE1B, dříve objevený v genomu obří želvy, dalšího dlouhověkého živočicha, je zodpovědný za udržování telomer – „čepic“ na koncích DNA, které se podílejí na jejím dělení. FEN1 se podílí na opravě dusíkatých bází DNA a proteinového produktu genu MCM6 je součástí helikázy, enzymu, který uvolňuje šroubovici DNA během replikace, transkripce a opravy.
Délka života suchozemských obratlovců často souvisí s velikostí těla: čím větší je zvíře, tím déle žije. Tato závislost je pozorována také u okouna tichomořského. Aby vědci mohli studovat, jak objevené geny ovlivňují velikost těla a zároveň životní podmínky, vytvořili lineární model, přičemž jako proměnné zvolili velikost těla a hloubku stanoviště (jako nejvhodnější parametr stanoviště pro posouzení). Analýza ukázala, že 81 z 91 genů bylo přímo nebo nepřímo spojeno s velikostí těla nebo hloubkou biotopu.
Biologové také zkoumali genomy okouna na přítomnost genomických přestaveb: někdy během procesu evoluce mohou být geny zmnoženy nebo přesunuty. Vědci objevili pozitivní korelaci mezi počtem kopií některých genů a očekávanou délkou života. Nejvíce genových multiplikací bylo nalezeno na chromozomu 1 in Sebastes aleutianus: Obsahuje 9 genů, jejichž počet kopií se pohybuje od 0 do 7. Z těchto devíti genů je šest členy rodiny butyrofilinů – proteinů, které inhibují syntézu cytokinů T lymfocyty, čímž vykazují protizánětlivý účinek. Mezi šesti členy butyrofilinové rodiny nalezenými na chromozomu 1 byl BTNL2, jejichž mutace v sekvenci jsou spojeny s rozvojem sarkoidózy. Na chromozomu je pouze 1 Sebastes aleutianus Bylo objeveno 22 míst duplikace genů kódujících butyrofiliny.
Vědci se již dlouhou dobu snaží identifikovat geny a faktory, které ovlivňují délku života. Psali jsme například o tom, jak mitochondriální stres prodloužil život háďátkům a transplantace mikroflóry omladila mozek starých myší.
Natalia Kondratenko
Našli jste překlep? Vyberte fragment a stiskněte Ctrl + Enter.

O prasatech a lidech
Jak proměnit prasátko v bezpečného dárce orgánů
První a jediný člověk, který dostal geneticky modifikované prasečí srdce, s ním žil pouhých 60 dní. Ani po roce a půl lékaři stále nezjistili, proč zemřel, ale mají podezření, že imunitní systém pacienta se s transplantací stále nevyrovnal. Možná by se odmítnutí dalo předejít, kdyby byl pacientovi transplantován lidský orgán vyrostlý od nuly, například v těle stejného prasete. Nyní čínští vědci získali první prasečí embryo s rudimentem lidské ledviny a bylo možné vyhodnotit, co je vlastně jednodušší: přestrojit prasečí ledvinu za lidskou nebo vypěstovat ve praseti skutečnou lidskou ledvinu. Vepřové maso v člověku Cizí orgán v těle člověka se nikdy nestane jeho vlastním. A to i v případě, že transplantace byla úspěšná a dárce je blízký příbuzný. Téměř vždy po takové operaci musí člověk po celý život užívat léky, které potlačují činnost imunitního systému. Co můžeme říci o případech, kdy je dárcem zvíře jiného druhu. Ve druhé polovině 20. století lékaři s tímto druhem transplantací hodně experimentovali. Jenže se ukázalo, že na xenotransplantace nepomáhají ani imunosupresiva. Prasečí srdce a opičí játra zřídka vydržely v lidském těle déle než několik dní nebo měsíců. Lékaři opustili tyto pokusy a obrátili se o pomoc na genetiky. Navrhli chovat „humanizovaná“ prasata – tedy zvířata, jejichž tkáně bude lidský imunitní systém souhlasit, že je uzná za vlastní. Nejjednodušší věc, kterou pro to lze udělat, je odstranit z povrchu buněk molekuly, které v lidském těle v zásadě neexistují. V případě prasečích buněk se jedná o disacharidový fragment dvou galaktóz (galaktóza-alfa-1,3-galaktóza). Abyste se ho zbavili, musíte z prasečího genomu vyříznout gen GGTA1: kóduje enzym, který pomáhá připojit tento ocas k buněčné membráně. Knokaut tohoto genu stačí k tomu, aby se zabránilo tomu, že náplast prasečí kůže nebo dokonce celá prasečí ledvina způsobí okamžité odmítnutí po transplantaci. Ale pokud orgán musí zůstat v lidském těle po dlouhou dobu, pak během týdnů a měsíců bude imunitní systém schopen dosáhnout hůře dostupných neznámých molekul. To znamená, že musíte jednat mazaněji. Například můžete nainstalovat malý kousek brzlíku pod kapsli vepřové ledviny. To je orgán, který trénuje imunitní buňky, aby nereagovaly na molekuly vlastního těla. V souladu s tím by brzlík dárce mohl trénovat lymfocyty hostitele, aby byly trpělivé s transplantovanými buňkami. Pod takovou ochranou může vepřová ledvina žít v člověku nejméně měsíc. Nebo můžete jít ještě dál a být v bezpečí před všemi možnými komplikacemi najednou. To udělali genetici ze společnosti Revvicor. Provedli až deset změn v genomu prasete, jehož srdce bylo později transplantováno lidem: vymazali tři geny zodpovědné za výskyt cizích molekul na povrchu; vymazali gen receptoru růstového hormonu (aby srdce nereagovaly na hostitelský hormon a nerostly), přidali šest lidských genů (dva inhibují zánět, dva brání vrozeným imunitním proteinům ve vazbě na buňky, dva blokují srážení krve). Pacient ale stejně zemřel. Se svým novým srdcem žil dva měsíce – a pak najednou začalo selhávat. Lékaři stále přesně nevědí, co se stalo. Možná to byl virus, který přenášelo zvíře. Nebo třeba v protilátkách, které lékaři pacientovi předepsali, když zaznamenali známky infekce (protože po imunosupresi mu nezůstaly téměř žádné protilátky). Nebo – u prasečích protilátek, které se vytvořily v srdci dárce a nakonec způsobily imunitní odpověď. Tak či onak imunitní systém na něco zareagoval. K odmítnutí přesto došlo. Člověk ve vepře Zda se jednoho dne podaří přinutit prasečí srdce, aby se v člověku spolehlivě zakořenilo, nelze nyní říci. Doposud proběhla pouze jedna taková operace. A zatím je pouze jeden příjemce vepřové ledviny. Proto je příliš brzy posuzovat vyhlídky takových operací a jejich možné důsledky. Můžeme však s jistotou říci, že lidské orgány by se měly zakořenit lépe než prasečí a měly by s sebou nést méně rizik. Pokud se naučíte, jak je pěstovat. Sbírat životně důležité orgány in vitro zatím není možné, ale můžete je zkusit vypěstovat uvnitř živého organismu – například prasete. K tomu potřebuje vypnout gen zodpovědný za vývoj jejího vlastního orgánu a zasadit do svého embrya lidské buňky (více jsme o této metodě hovořili v materiálu „Pig Heart“). Pokud prase přežije a požadovaný orgán vyroste, můžeme s jistotou říci, že je to člověk. Pravda, k tomu budeme muset vyřešit ještě jeden problém – prasečí buňky nepřevlékat za lidské, ale naopak postarat se o to, aby se lidské buňky staly v prasečím embryu svými a nezabíjely je sousedé. Embrya chimér se obvykle odebírají, když jsou v nejranějších fázích vývoje. Prasečí embryo v tuto chvíli vypadá jako shluk buněk, které se ještě nezačaly distribuovat mezi orgány a tkáně. Můžete do ní napíchnout lidské embryonální kmenové buňky – jsou přibližně ve stejném stádiu – a doufat, že se promísí s davem a budou se podílet na stavbě orgánů stejně jako prasečí buňky. Protože v tak raném embryu není žádná tkáň, není tam žádná krev, což znamená, že imunitní odmítnutí je nemožné. Lidským buňkám však brání v klidné integraci jiný mechanismus – buněčná konkurence. Zdá se, že buňky uvnitř embrya vysílají signál svým sousedům, aby zahájili apoptózu. A pokud sousedé z nějakého důvodu neprodukují dostatek proteinů, které blokují apoptózu – například proto, že mají nějaké poškození nebo nemají dostatek energie – pak zemřou. Proto transplantované buňky v chimérických embryích špatně zakořeňují, zvláště pokud nemluvíme o blízce příbuzných živočišných druzích. Rekordní obsah lidských buněk, kterého bylo dosaženo u chimérického embrya u opice, je 7 procent, u myši – 4 procenta. V chimérách s prasaty donedávna lidské buňky přežívaly ještě hůře a tvořily jen zlomek procenta. Aby pomohli buňkám uvnitř chiméry přežít, vědci se snaží geneticky deaktivovat jejich program apoptózy. Američtí vědci tak v roce 2021 vytvořili buněčnou kulturu bez genu TP53, který kóduje hlavní protein v programu apoptózy. Když byly takové buňky implantovány do prasečího embrya, přežily a dokonce z nich začaly růst skutečné svaly – protože prasata byla odebrána s vadou ve vývoji svalů. Nyní se další skupina vědců, čínští biologové pod vedením Liangxue Lai, pustila do pěstování lidské ledviny uvnitř prasete – protože ledviny jsou k transplantaci potřeba mnohem více než svaly. Za tímto účelem vědci vložili konstrukt několika fragmentů DNA do genomu lidských buněk. Začalo to signální sekvencí, která reagovala na přítomnost specifického léku (doxycyklinu), což znamená, že geny po ní mohly být spuštěny příkazem. Další byly kopie dvou genů, z nichž jeden (BLC2) zastavuje apoptózu a druhý (MYCN) se podílí na dělení. Tento genetický design neměl zastavit program buněčné smrti, ale naopak podpořit program přežití. Kromě toho byly buňky značeny fluorescenčním proteinem, aby byly snadno vidět uvnitř chiméry. Poté, co byly tyto buňky „naprogramovány“ k přežití pomocí doxycyklinu, byly implantovány do prasečích embryí. A podle výpočtů autorů článku zabírali přibližně desetinu plochy embrya. Nemusí to nutně znamenat, že tvořily deset procent všech buněk, ale rozhodně v nich tvořily znatelný (pod fluorescenčním mikroskopem) zlomek. Aby ledvina vyrostla z lidských buněk, bylo potřeba upravit i hostitelské prase. Pomocí genových editorů vědci vytvořili dva nefunkční geny (SIX1 a SALL1), které jsou zodpovědné za diferenciaci ledvinových buněk a tvorbu tubulů. Bez lidských buněk byla prasečí embrya s defekty v těchto genech životaschopná, ale jejich ledviny se nevyvíjely tak dobře jako normálně. Když se vědci pokusili sestavit chiméru z upraveného prasečího embrya a upravených lidských buněk, získali pět životaschopných embryí, která se zakořenila v náhradních prasečích matkách. O měsíc později vědci tato těhotenství ukončili a embrya z dělohy odstranili. V oblasti, kde se měly nacházet jejich ledviny, si vědci pod mikroskopem všimli jasně červené záře – tedy lidské buňky zaujaly své zamýšlené místo. Ukázalo se, že ledvinový rudiment je o něco více než polovina člověka – podíl světelných buněk v něm byl 50–65 procent. Dvojité GMO To, co vyrostlo v čínském experimentu, samozřejmě ještě není plnohodnotná ledvina. Toto je pouze základ a částečně postavený z prasečích buněk. Navíc byl získán s extrémně nízkou účinností – pouze 5 embryí z 1820 zakořenilo. Projekt má před sebou ještě dlouhou cestu, aby dohnal upravená prasata a jejich orgány, které se již transplantují pacientům. Přesto se jedná o první rudiment lidské ledviny u prasete – a obecně první rudiment životně důležitého lidského orgánu získaného touto metodou. To znamená, že si již dokážeme představit, o kolik je tato technologie ekonomičtější ve srovnání s humanizací prasat – alespoň co se týče nutných genetických úprav. Prase, které se stalo prvním modifikovaným dárcem lidského srdce, neslo deset genetických změn. A ani ty nepomohly uklidnit imunitní systém nového majitele. Možná budou další generace dárcovských prasat potřebovat více těchto úprav. Kolik přesně, zatím není jasné. Například americký genetik George Church, známý svými ambiciózními nápady a velkými projekty, tvrdil, že je nutné z prasečího genomu vyčistit všechny endogenní retroviry – mobilní elementy, které se mohou pohybovat celým genomem a teoreticky mohou „skákat“ z dárcovského orgánu do lidských buněk. Jedná se o dalších 25 dodatečných úprav, celkem tedy téměř čtyřicet. A to asi není limit. V chiméře člověk-prase je zatím méně úprav: dvě v lidském genomu a další dvě v genomu prasete. Lai Liangxue a jeho spoluautoři ale tuší, že časem bude potřeba víc. Za prvé, se současným experimentálním designem stále nebude možné vypěstovat ledvinu, která neobsahuje jedinou prasečí buňku. I když vědci dosáhnou, že každý jednotlivý tubul ledviny je lidský, stále budou existovat krevní cévy a prvky pojivové tkáně. A pokud chceme, aby ledvina byla pro lidský imunitní systém zcela neviditelná, bude muset prase dárce vypnout i geny spojené s vývojem kapilár. Bude takové prase životaschopné? A co se stane s jejími dalšími orgány, kde se zřejmě usadí lidské buňky a vyklíčí lidské cévy? Za druhé, takto vedený experiment se může ukázat jako eticky riskantní. Co když se lidské buňky stanou součástí nejen ledvin, ale i nervového systému? Tam samozřejmě nebudou konkurenceschopní – a přesto to bude prasečí mozek s lidskými buňkami. Vědecká komunita dosud nestanovila žádný prahový podíl lidských buněk, po jehož dosažení je mozek považován za člověka. Jakýkoli experiment s chimérickým nervovým systémem tedy může vyvolat otázky etických komisí. Vědci proto svůj experiment zastavili 28. den vývoje. A zkontrolovali, že v prekurzorech mozku a míchy v embryích jsou pouze jednotlivé lidské buňky a v základech gonád – vůbec ne jediná. Lai Liangxue a spoluautoři se domnívají, že z etického hlediska lze jejich metodu učinit bezpečnější provedením ještě větších úprav genomu lidských buněk. Tedy vyříznout odtud některé geny, které jsou klíčové pro vývoj nervového systému a gonád. Pak se obě části chiméry ukážou jako méněcenné – ani jedna nepřežije sama o sobě a výsledný organismus bude mozaikou orgánů různých druhů. Vědci nespecifikují, které geny by mohly být dobrým cílem pro takové úpravy. A pro každý případ udělají výhradu: nové genetické zásahy mohou zabránit tomu, aby lidské buňky vytvořily plnohodnotnou ledvinu. Tak či onak, bude to vyžadovat mnohem více experimentů, abyste zjistili, zda je zde možný kompromis.

My lidé jsme hrdí na své dlouhé (a stále delší) životy, ale překvapivým faktem je, že pokud jde o dlouhověkost Homo sapiens výrazně nižší než někteří další zástupci živočišného světa, včetně žraloků, velryb a dokonce i obojživelníků nebo měkkýšů. V tomto článku se dozvíte o 11 nejdéle žijících zástupcích různých skupin zvířat v pořadí prodlužující se délka života.
Nejdéle žijícím hmyzem je termití královna (50 let)

Lidé si obvykle myslí, že hmyz žije jen pár dní nebo týdnů, ale když jste obzvlášť důležití, všechna pravidla se hroutí. Bez ohledu na druh vládne kolonii termitů král a královna. Jakmile je královna inseminována samcem, pomalu zvyšuje produkci vajíček, počínaje několika desítkami vajíček a nakonec dosáhne cíle asi 25 000 vajíček za den (ne všechna tato vejce samozřejmě dozrají). Je známo, že termití královny se zdaleka nestaly večeří predátorů, je známo, že dosahují věku 50 let, a králové termitů (kteří tráví téměř celý život zavření v páření se svými plodnými královnami) mají také relativně dlouhé životy. Pokud jde o jednoduché termity dělnice, které tvoří převážnou část kolonie, dožívají se maximálně jednoho až dvou let. To je osud obyčejného otroka.
Nejdéle žijící rybou je koi kapr (50 let)

Ve volné přírodě se ryby zřídka dožívají více než několika let a dokonce i akvarijní zlaté rybky vyžadují dobrou péči, aby dosáhly desetiletí. Mnoho ryb na světě by ale závidělo barevného koi kapra oblíbeného v Japonsku a dalších částech světa, včetně Spojených států. Stejně jako ostatní druhy kaprovitých, koi mohou odolat široké škále podmínek prostředí, ačkoli (zejména vzhledem k jejich jasným barvám, které mají lidé rádi) nejsou příliš dobře maskováni pro ochranu před predátory. Předpokládá se, že jednotliví koi žijí déle než 200 let, ale nejrozšířenější odhad mezi vědci je 50 let, což je mnohem déle než průměr koi ve vašem akváriu.
Nejdéle žijící pták je ara (100 let)

Tito barevní papoušci jsou schopni se po celý život rozmnožovat, přičemž samice inkubují vajíčka a starají se o kuřata, zatímco samci shánějí potravu. S životností až 60 let ve volné přírodě a až 100 let v zajetí jsou ary téměř stejně dlouhé jako lidé. Je ironií, že ačkoli tito ptáci mohou žít velmi dlouho, mnoho druhů je ohroženo kvůli touze lidí chovat je jako domácí mazlíčky a odlesňování tropických pralesů. Dlouhá životnost arů a dalších členů čeledi papoušků vyvolává otázku: Protože se ptáci vyvinuli z dinosaurů a protože víme, že mnoho dinosaurů bylo stejně malých a barevných, mohli někteří z těchto prehistorických plazů dosáhnout věku jednoho století?
Nejdéle žijícím obojživelníkem je evropský proteus (100 let)

Pokud jste byli požádáni, abyste pojmenovali zvířata, která pravidelně dosahují značky století, slepý obojživelník je evropský proteus (Proteus anguinus) bude pravděpodobně poslední na vašem seznamu: jak může křehký 30cm obojživelník žijící v jeskyni přežít byť jen pár týdnů ve volné přírodě? Přírodovědci připisují dlouhověkost evropského Protea jeho neobvykle pomalému metabolismu. Tito obojživelníci dosáhnou pohlavní dospělosti pouze v 15 letech a také kladou vejce ne více než jednou za 12 let. Kromě hledání potravy se téměř nepohybují. Navíc vlhké jeskyně jižní Evropy, kde žije evropský proteus, nemají prakticky žádné predátory, což mu umožňuje žít ve volné přírodě až 100 let. Pro srovnání, japonský obří mlok, který je na druhém místě v seznamu dlouhověkých obojživelníků, jen málokdy překoná hranici 50 let.
Nejdéle žijící primát je člověk (100 let)

Lidé se často dožívají 100 let i více, což z nás dělá rekordmany v nejdelší očekávané délce života mezi primáty. Na světě je asi půl milionu lidí, kterým je kolem 100 let. Před desítkami tisíc let Homo sapiens byl považován za staršího, pokud se dožil 20-30 let, a až do 18. století průměrná délka života zřídka přesáhla 50 let. Na vině byla především vysoká kojenecká úmrtnost a náchylnost ke smrtelným nemocem. Pokud se vám však v kterémkoli okamžiku lidské historie podařilo přežít rané dětství a dospívání, vaše šance dožít se 50, 60 nebo dokonce 70 se výrazně zvýšily. Čemu můžeme připsat tento úžasný nárůst dlouhověkosti? No, jedním slovem civilizace, zejména hygiena, medicína, výživa a spolupráce (během doby ledové nechal kmen lidí své starší příbuzné s největší pravděpodobností hladovět v mrazu a my dnes vynakládáme zvláštní úsilí, abychom se o našeho osmdesátníka starali příbuzní.)
Nejdéle žijícím savcem je velryba grónská (200 let)

Větší savci mají obvykle relativně dlouhou životnost, ale i podle tohoto standardu jsou velryby grónské daleko napřed a často překračují hranici 200 let. Nedávno analýza genomu velryby grónské vrhla určité světlo na tuto záhadu: ukázalo se, že tyto velryby mají jedinečné geny, které pomáhají s opravou DNA a odolností vůči mutacím (a tedy rakovině). Protože velryba grónská žije v arktických a subarktických vodách, její relativně pomalý metabolismus může mít také něco společného s její dlouhověkostí. Dnes je na severní polokouli asi 25 000 velryb grónských, což je pozitivní trend obnovy populace od roku 1966, kdy bylo vynaloženo velké mezinárodní úsilí k omezení lovců velryb.
Nejdéle žijícím plazem je obří želva (300 let)

Obří želvy z Galapág a Seychelských ostrovů jsou klasickým příkladem „ostrovního gigantismu“ – tendence zvířat omezených na ostrovní stanoviště a bez přirozených predátorů dorůstat do neobvykle velkých rozměrů. A tyto želvy mají životnost, která dokonale odpovídá jejich váze, v rozmezí od 200 do 500 kg. O želvách obřích je známo, že žijí déle než 200 let a existují všechny důvody se domnívat, že ve volné přírodě pravidelně překonávají hranici 300 let. Stejně jako u některých dalších zvířat na tomto seznamu jsou důvody dlouhověkosti želv obrovských zřejmé: tito plazi se pohybují velmi pomalu, jejich bazální metabolismus je extrémně nízký a jejich životní fáze bývají poměrně zdlouhavé (například obr Aldabra želva dosáhne pohlavní dospělosti až ve věku 30 let).
Nejdéle žijícím žralokem je žralok grónský (400 let)

Pokud by na světě existovala nějaká spravedlnost, byl by žralok grónský stejně slavný jako žralok bílý: je také velký (někteří dospělí přesahují 1000 kg) a mnohem exotičtější vzhledem k jeho severnímu arktickému prostředí. Možná si myslíte, že žralok grónský je nebezpečný jako čelisťová hvězda, ale zatímco hladový bílý žralok vás kousne napůl, žralok Grenadský je pro člověka relativně neškodný. Nejpozoruhodnějším faktem o žraloku grónském je však jeho životnost přes 400 let. Tato dlouhověkost se vysvětluje chladným stanovištěm a velmi nízkým metabolismem. Tito žraloci překvapivě dosáhnou pohlavní dospělosti po 100 letech, a to navzdory skutečnosti, že většina ostatních obratlovců v tomto věku je nejen sexuálně neaktivní, ale je již dávno mrtvá!
Nejdéle žijící měkkýš je islandský cyprina (Ostrov Arktidy) (500 let)

500 let stará škeble zní jako vtip, protože většina škeblí je prakticky nehybná, tak jak můžete s jistotou říct, zda je živá nebo ne? Existují však vědci, kteří takové věci studují, a zjistili, že Cyprina Icelandica (Ostrov Arktidy) může žít doslova staletí, o čemž svědčí jeden exemplář, který překročil hranici 500 let (stáří škeble poznáte podle sčítání růstových prstenců na její krunýři). Je ironií, že cyprina je v některých částech světa také populární jídlo, což znamená, že většina měkkýšů nikdy nebude moci oslavit své XNUMX. výročí. Biologové zatím nezjistili proč Ostrov Arktidy žijí tak dlouho, ale jedním z důvodů mohou být relativně stabilní hladiny antioxidantů, které zabraňují poškození buněk odpovědnému za většinu známek stárnutí u zvířat.
Nejdéle žijícími mikroorganismy jsou endolity (10 000 let)

Stanovení délky života mikroorganismů je poměrně složitý proces. V jistém smyslu jsou všechny bakterie nesmrtelné, protože svou genetickou informaci šíří neustálým dělením (spíše než jako většina vyšších zvířat sexem). Termín “endolity” označuje bakterie, houby, archaea nebo řasy, které žijí hluboko pod zemí ve skalních štěrbinách, korálech a schránkách zvířat. Výzkum ukázal, že někteří jedinci z endolitových kolonií podstupují buněčné dělení pouze jednou za sto let a jejich délka života dosahuje 10 000 let. Technicky se to liší od schopnosti některých mikroorganismů oživit se po stagnaci nebo hlubokém zmrazení po desítkách tisíc let. Endolity jsou doslova neustále „živé“, i když nejsou příliš aktivní. Jsou to autotrofní organismy, které neprovádějí metabolismus pomocí kyslíku nebo slunečního záření, ale pomocí anorganických chemikálií, které jsou v jejich stanovištích prakticky nevyčerpatelné.
Nejdéle žijící bezobratlý živočich je Turritopsis dohrnii (potenciálně nesmrtelný)
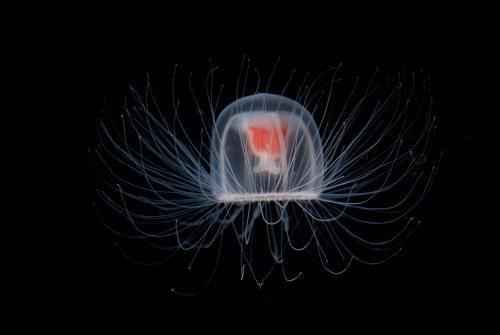
Neexistuje žádný spolehlivý způsob, jak určit, kolik let se průměrná medúza dožívá. Tito bezobratlí jsou tak křehcí, že se nehodí k intenzivnímu výzkumu v laboratořích. Žádný žebříček dlouhověkých zvířat by však nebyl úplný bez zmínky Turritopsis dohrnii je druh medúzy, která je schopna se po dosažení pohlavní dospělosti vrátit do stadia polypu, díky čemuž je potenciálně nesmrtelná. Je však téměř neuvěřitelné, že každý jedinec T. dohrnii může žít miliony let. Biologická „nesmrtelnost“ neznamená, že vás nesežerou jiná zvířata nebo vás nezabijí náhlé změny podmínek prostředí. Chovat medúzy je bohužel téměř nemožné T. dohrnii v zajetí, výkon, který dosud dokázal pouze jeden vědec pracující v Japonsku.
















